Эффекторы и вторичные мессенджеры в сигнальных путях клетки: роль аденилатциклазы и циклического аденозинмонофосфата
Подробное рассмотрение механизмов действия аденилатциклазы, циклического аденозинмонофосфата и протеинкиназы А в передаче внутриклеточных сигналов. Описание примеров их участия в регуляции различных клеточных процессов, включая гликогенолиз, сократительную активность миокарда и секрецию электролитов в кишечнике.
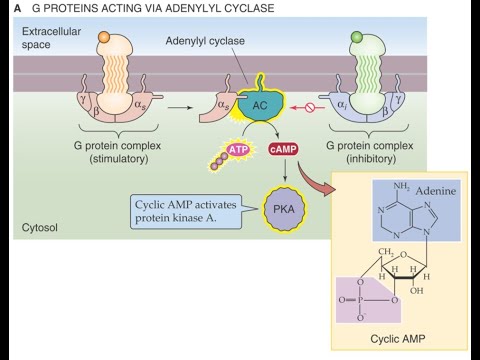
Анализ внутриклеточных эффектов α- и β-субъединиц G-белков и их регуляторная роль в сигнальных каскадах
Какие основные эффекторы воздействуют на активность аденилатциклазы?
Основными эффекторами, воздействующими на активность аденилатциклазы, являются:
- - Стимулирующие Gα-субъединицы, которые повышают активность аденилатциклазы и увеличивают уровень цАМФ - Ингибирующие Gα-субъединицы, которые снижают активность аденилатциклазы и уменьшают концентрацию цАМФ
Какова роль цАМФ в передаче внутриклеточных сигналов?
Циклический аденозинмонофосфат (цАМФ) является важным вторичным мессенджером, который играет ключевую роль в передаче внутриклеточных сигналов:
- - Цикликческий АМФ активирует протеинкиназу А, которая фосфорилирует многочисленные клеточные белки-мишени (ионные каналы, ферменты, факторы транскрипции и др.), изменяя их активность и функции. - Цикликческий АМФ регулирует активность цАМФ-зависимых ионных каналов, вызывая деполяризацию или гиперполяризацию клеточной мембраны. - Повышение уровня цАМФ в ядре стимулирует транскрипцию генов, содержащих в промоторных областях CREB-элементы, что обеспечивает долговременные эффекты сигнальных каскадов.
Каким образом аденилатциклаза и цАМФ участвуют в механизме действия холерного токсина?
Холерный токсин продуцируемый бактериями Vibrio cholerae оказывает свое патогенное действие, воздействуя на аденилатциклазную систему:
- 1. Токсин проникает в клетки кишечного эпителия и его А-субъединица связывается с Gα-субъединицей, блокируя её ГТФ-азную активность. 2. Это приводит к постоянной активации аденилатциклазы и сверхпродукции циклического АМФ в клетках. 3. Избыточный цАМФ активирует протеинкиназу А, которая фосфорилирует хлорные каналы в апикальной мембране энтероцитов. 4. Открытие хлорных каналов вызывает секрецию хлора, натрия и воды в просвет кишечника, что приводит к развитию тяжелой водянистой диареи.
Каким образом цАМФ регулирует активность протеинкиназы А?
Активность протеинкиназы А регулируется следующим образом:
- 1. В отсутствие цАМФ, каталитические субъединицы протеинкиназы А связаны с регуляторными субъединицами и фермент неактивен. 2. Повышение внутриклеточной концентрации цАМФ приводит к связыванию цАМФ с регуляторными субъединицами, что вызывает их диссоциацию от каталитических. 3. Освободившиеся каталитические субъединицы становятся активными и могут фосфорилировать различные белки-мишени. 4. Активность протеинкиназы А также регулируется обратной связью - фосфорилируя фосфодиэстеразу, протеинкиназа А ускоряет разрушение цАМФ. 5. Другим механизмом регуляции является активация фосфатаз, которые дефосфорилируют и инактивируют протеинкиназу А.
Как цАМФ-зависимая протеинкиназа А влияет на сократительную функцию миокарда?
Активация цАМФ-зависимой протеинкиназы А в кардиомиоцитах приводит к следующим эффектам, усиливающим сократительную функцию миокарда:
- 1. Протеинкиназа А фосфорилирует и активирует кальциевые каналы L-типа в сарколемме, что увеличивает приток кальция в клетку. 2. Фосфорилирование рианодиновых рецепторов саркоплазматического ретикулума облегчает высвобождение кальция из внутриклеточных депо. 3. Фосфорилирование фосфоламбана, ингибитора кальциевого насоса SERCA, снижает его ингибирующее действие, ускоряя обратный захват кальция в саркоплазматический ретикулум. 4. Повышение внутриклеточной концентрации кальция усиливает сократительные процессы.
Каким образом цАМФ-зависимая протеинкиназа А регулирует транскрипцию генов?
Протеинкиназа А, активированная цАМФ, оказывает влияние на транскрипцию генов следующим образом:
- 1. Протеинкиназа А фосфорилирует фактор транскрипции CREB (cAMP response element-binding protein), повышая его активность. 2. Фосфорилированный CREB связывается с промоторными CRE-элементами (cAMP response elements) в генах-мишенях, активируя их транскрипцию. 3. Гены, содержащие CRE-элементы, кодируют различные белки, участвующие в долговременной адаптации клетки, в том числе нейротрансмиттеры, нейропептиды и факторы роста. 4. Таким образом, цАМФ-зависимая протеинкиназа А обеспечивает связь между быстрыми внутриклеточными сигнальными каскадами и долговременными изменениями в экспрессии генов.